на сколько отличен фотосинтез у водных и наземных растений
Практически ничем не отличается.
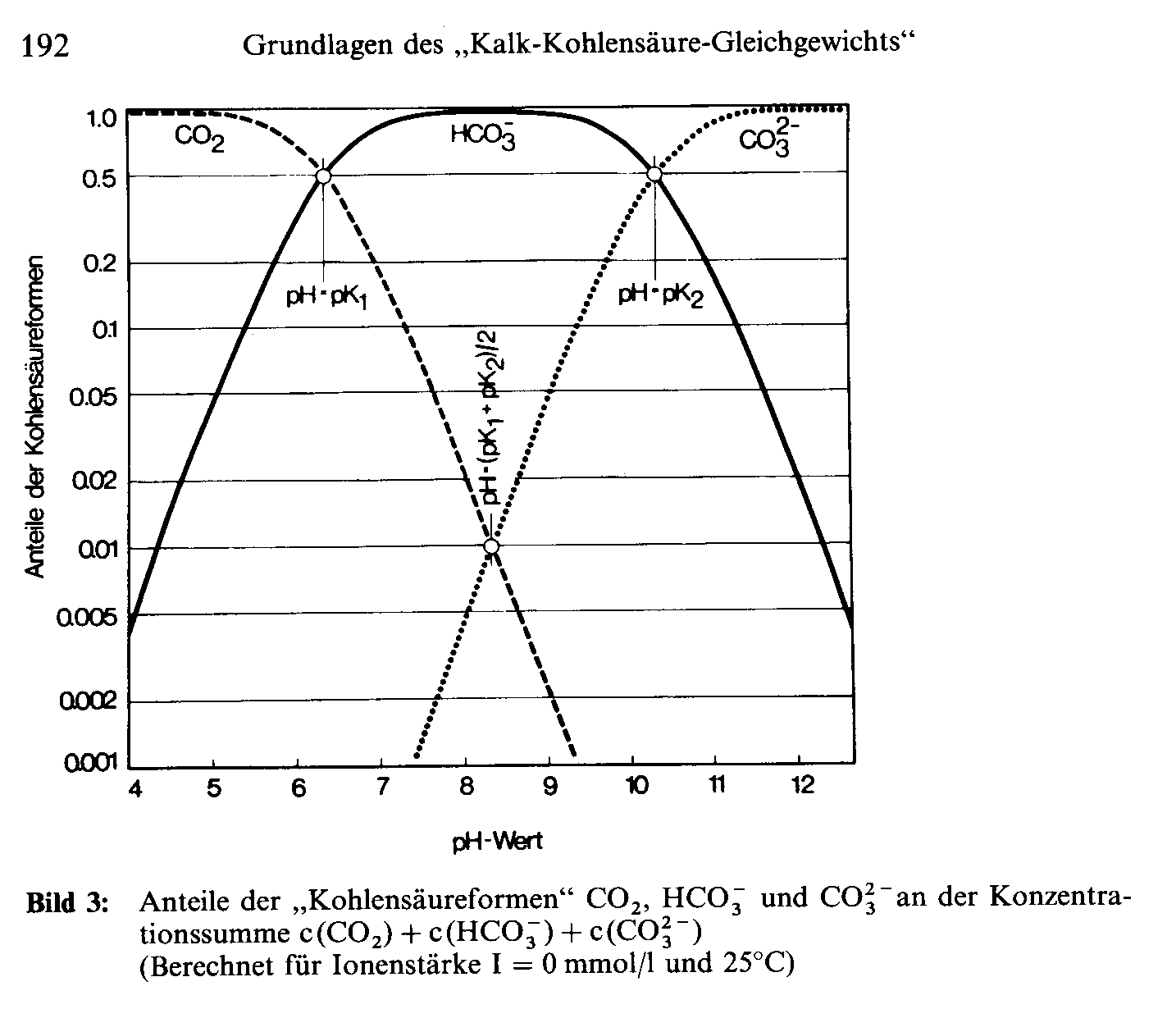
так вот и тут меня Жека вместе с Краузе засмущали. я вот нигде не читал чтоб растения в водном фотосинтезе интересовали именно анионы гидрокарбонатов. а получается что именно они и интересуют, ибо свободнорастворенного чистого СО2 в воде вроде как чертовски мало. он же образует углекислоту взаимодействуя с водой, а та уже разваливается на ионы. и если анион не связан мощным катионом кальция, магния или хрензнает чего двух или более валентного, то растения с ним справляются - рвут и забирают углерод!причем не образуя предварительно СО2, они его так растеряли б!
а на воздухе ловят и рвут прямо СО2. а ты говоришь не отличается!